서론
폐암은 세계적으로 사망률이 높은 암일 뿐만 아니라, 2017년 국내 암통계에서도 사망률이 가장 높은 암(전체 암사망자의 22.8%인 17,969명)으로 보고되어, 예후가 극히 불량한 암이다. 폐암은 비소세포폐암(선암, 편평상피세포암 등)과 소세포폐암으로 분류하는데, 전체 폐암 중 86.4%가 비소세포폐암, 13.6%는 소세포폐암이 차지한다.
폐암의 치료법은 수술, 방사선치료, 항암치료로 분류하는데, 초기 비소세포폐암은 수술적 치료를 함으로써 완치를 기대할 수 있으나, 상당수의 환자가 진단 당시에 수술이 불가능한 전이성 폐암으로 발견된다. 여기서 다루고자 하는 항암 치료 는 진행된 폐암 환자에서 삶의 질을 높이고, 생명 연장 및 증상 조절을 목표로 하는데, 약 45%의 환자가 이미 4기로 대부분 다른 장기에 전이가 있는 상태에서 발견되는 폐암에서는, 항암 치료의 역할이 타 암종에 비해 매우 중요하다고 할 수 있다.
2000년도 초반 이후 상피세포성장인자 수용체(Epidermal Growth Factor Receptor, EGFR) 유전자 변이를 갖고 있거나 Anaplastic Lymphoma Kinase (ALK) 유전자 변이를 갖고 있는 환자들을 대상으로 하는 표적치료제들의 개발로 평균 수명이 1년 이내에서 2년 또는 3년까지 연장되었다. 하지만 특정 유전자변이(driver gene mutation)를 갖고 있는 환자들 은 대부분 비흡연 폐암환자들로 전체 폐암 환자의 약 30% 정도이고 나머지 대부분 흡연과 관련된 폐암환자의 경우는 기존의 세포독성 항암치료 이외에는 마땅히 치료할 수 있는 약제가 없었다.
2012년 NEJM에 기존에 항암치료를 여러 번 시행 받은 비소세포폐암, 신장암, 악성흑색종 환자들을 대상으로 면역항암제 투여 후 종양억제 효과에 대한 결과가 발표된 이래로 면역항암제를 이용한 수많은 임상 결과들이 나오고 있으며 기존약제들과는 작용 기전이 다르고 좋은 치료 결과들을 보이면서 최근 기본적인 폐암치료법으로 위치를 차지하였다.
종양면역의 이해
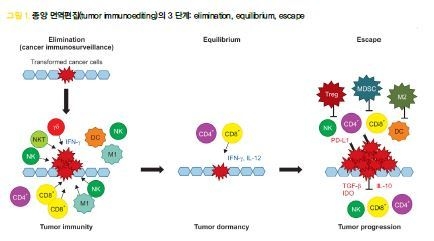
우리 몸의 면역 시스템은 암세포와 같이 이질적인 세포가 발생하면 곧 이를 non-self로 인식하고 세포독성 T세포들이 변이가 일어난 세포들을 사멸시킨다. 이러한 점검 과정을 immune surveillance라 하며 immune surveillance 과정을 통해 사멸이 되던 일부 암세포들이 몇몇 기전을 통해 회피하게 되면 우리 몸의 면역시스템과 암세포와 평형(equilibrium) 과정을 통해 암세포들이 사멸되지 않게 된다.
그 후 일부 암세포에서는 주변 면역시스템을 억제시키는 특정 효소(indoleamine 2,3-dioxygenase)나 사이토카인(IL-10, TGF-β등)을 분비하거나 Programmed Death Ligand-1 (PD-L1)을 세포 표면에 발현해서 암세포를 공격하 는 세포독성 T세포 활성을 억제시킴으로써 immune surveillance로부터 벗어나는 immune escape 과정을 통해 점차 암이 성장하게 된다.
이렇게 암세포가 우리 몸의 면역시스템으로부터 사멸되는 elimination 과정을 거치다가 일부 암세포들이 우리 면역세포들과 평형관계(equilibrium) 과정을 거쳐 결국에는 면역회피(immune escape)를 과정을 거침으로써 암세포들이 성장과 원격전이가 가능해지는데 이러한 일련의 암세포의 변형 과정을 종양 면역편집(tumor immunoediting)이라고 한다(그림 1).
면역항암제의 기전 및 특징
면역항암제는 우리 몸의 면역세포를 활용하여, 암세포 특이항원을 인식하고, 면역반응을 유발하여 암세포를 사멸시키는 치료방법이다. 2010년 이전에도 사이토카인 또는 백신을 투여하거나 면역세포인 T세포 자체를 투여하는 등의 면역치료가 사용되었으나, 효과가 적고 독성이 높아 활용되지 못하였다.
최근에 암세포와 면역세포의 결합인 면역관문(immune checkpoint)이 리간드와 수용체 사이의 상호작용에 의해 나타나는 것이 알려지고, 항체 등으로 수용체 혹은 리간드를 차단하는 약제인 면역관문억제제가 개발되어 비소세포폐암 치료에서 좋은 결과를 보여주고 있다.
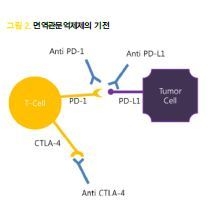
면역관문 물질 중, Cytotoxic T Lymphocyte Antigen-4 (CTLA-4)는 활성화된 세포독성 T세포에 의해 나타나서 T세포의 활성을 억제하는 표적인자이다. CTLA-4는 수지상세포(Antigen Presenting Cell, APC)가 암세포의 특정 antigenicity를 naïve T세포에게 교육을 시키는데 이러한 과정을 priming이라고 하며 이 과정에서 naïve T세포를 활성화시키지 못하게 하는데 관여하는 것이 CTLA-4 이다.
또한 Programmed Death-1 (PD-1)은 세포독성 T세포 표면에 존재하며, 이수용체의 리간드인 Programmed Cell Death- Ligand 1 (PD-L1)과 결합하여 활성화된 T세포를 억제하는 물질이다. 면역관문억제제는, anti-
CTLA-4 항체를 만들어 CTLA-4에 대한 결합을 차단하거나, 암세포에서 ‘면역회피물질’로 발현하는 PD-L1과 T세포의 PD-1의 결합을 억제함으로서 T세포가 정상적인 작용을 하도록 하는 것이다(그림 2).
CTLA-4와 PD-L1 시스템은 주로 면역 비활성화에 관여하는데, 이를 이용해 두 과학자 James P. Allison (MD Anderson Cancer Center)와 Tasuku
Honjo (Kyoto University)가 면역치료 약제들로 종양치료의 획기적인 변화를 유도하였기에 그 업적으로 2018년도 노벨 생리 의학상을 수상하였다.
면역항암제의 가장 큰 특징은, 인체 면역시스템의 기억능력과 적응력을 이용하기 때문에 기존의 세포독성 항암제와 표적치료제가 보여주지 못한 지속가능한 항암효과를 보인다는 점이다. 한 면역항암제의 연구결과를 보면, 1년 생존률이 42%, 3년생존률이 20%에 달하는 장기생존을 보이며, 일부환자는 면역치료를 중단한 후에도 항암효과가 오랫동안 지속되는 것을 보인다. 더욱이 부작용은 세포독성 항암제보다 적어서 치료를 받는 동안에 환자들의 삶의 질도 향상되었다.
면역항암제의 종류
현재 사용되고 있는 면역관문억제제는 크게CTLA-4를 표적으로 하는 억제제(ipilimumab, tremelimumab)와 PD-1/PD-L1의 interaction을 억제하는 약제가 있다. 항 CTLA-4 항체는 주로악성 흑색종에서 적응증을 갖고 있으며 폐암에서는 단독치료로 적응증을 갖고 있지 못하며, PD-L1 또는 PD-1 항체와의 병합치료와 관련된 임상 연구들이 진행되고 있다.
PD-1/PD-L1 interaction을 억제하는 약제는 크게 PD-1을 표적으로 하는nivolumab (OptivoⓇ)과 pembrolizumab (Keytruda Ⓡ)이 있으며, PD-L1을 표적으로 하는 단클론 항제 약제로는 atezolizumab (TecentriqⓇ)과 durvalumab (ImfinziⓇ)이 있다(표 1). 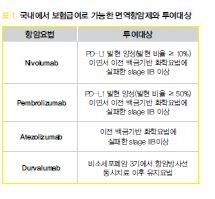
Pembolizumab은 이전 백금계 항암치료에 실패한 환자에게 시행한 임상연구에서, 전체 치료 반응율은 19.4%인데, 종양에서의 PD-L1 발현율이 50% 이상인 환자에서 45.2%의 반응율을 보이는 것으로 나타났다. 또한 docetaxel과 비교하여 PDL1발현율이 50% 이상인 경우, 생존기간이 무려 6개월 이상 연장되어, FDA 승인 시에 PD-L1 발현율 검사인 22C3 pharmDx라는 면역화학검사를 동반진단검사로 함께 허가했다.
Nivolumab은 편평상피세포암과 비편평상피세포암을 대상으로 한 각각의 연구에서, 모두 표준치료인 docetaxel과 비교하여 무진행 생존기간과 전체 생존기간이 통계적으로 의미있게 향상되었다. Pembrolizumab과 달리 nivolumab은 PD-L1의 발현정도와 치료 성적과는 관계가 없어, FDA도 PD-L1 발현이나 조직에 관계없이 승인하였다.
국내에서는 28-8 pharmDx 혹은 SP263 항체를 이용한 면역화학검사로 10% 이상의 발현율을 보이는 경우 보험급여를 인정하였다. Atezolizumab은 최근 국내 PD-L1 발현율과 관계없이 이전 백금기반 화학요법에 실패한 stage IIIB이상 환자에서 보험 승인을 받았다.
이외에도 후발 약제로서 anti-PD-L1 제제인, durvalumab이 여러 임상시험에서 좋은 효과를 보여, FDA 허가를 받아 국내에서도 폐암 3기 환자에서 항암방사선 동시치료 이후 추가 항암요법으로 허가를 받았다. 흥미로운 점은 면역관문억제제들간 혹은 세포독성 항암제, 표적치료제 등과의 병합요법을 통하여 치료효과를 상승시킬 수 있어, 이러한 임상 연구가 활발히 이루어지고 있다.
면역항암제의 부작용
2012년 면역항암치료가 NEJM에 발표된 이래로 많은 임상연구를 통해 비소세포폐암의 치료 패러다임이 바뀌고 있는데, 면역항암치료가 주목을 받고 있는 이유 중에 하나가 기존의 세포독성 항암치료에서 문제가 되던 부작용 이슈가 면역항암치료에서는 그렇게 큰 문제가 되지 않는다는 것이다.
즉 기존의 세포독성 항암제와는 다른 작용기전을 가지고 있기 때문에 세포독성 항암제가 갖고 있는 혈액학적 독성, 탈모, 위장장애(구역, 구토, 설사 등) 같은 부작용은 거의 발생하지 않는다. 대신 우리 신체의 면역시스템을 활성화 시키기 때문에 다양한 자가면역 관련 부작용들이 발생 할 수 있으며기존의 약제와는 다른 부작용들이 발생하기 때문에 그런 부작용들을 치료할 수 있는 관련 전문가와 협진하여 부작용 발생에 대처할 것을 권고하고 있다.
갑상선기능저하증, 피부 발진, 폐렴, 장염, 간염, 뇌하수체염 등의 자가면역질환이 나타날 수 있으나, 대부분 조기에 발견하여 관리하게 되면 심각한 부작용을 막을 수 있어, 이에 대한 환자 교육과 적절한 추적검사를 요한다. 그 외 피로감, 식욕부진, 설사 등이 나타날 수 있지만, 세포독성 항암제에 의한 부작용보다는 경미하게 보고 되었다.
향후 전망
면역항암치료는 우리 몸의 면역시스템을 이용하여 암을 치료하는 것이기 때문에 특이성이 좋고 또한 일부 면역세포 는 memory T세포로 변화하여 그 항암효과가 오래 지속된다는 장점이 있다. 또한 기존의 치료약제와는 다른 기전을 가지고 있기 때문에 다른 항암치료 약제와의 병합치료가 좋은 임상 결과를 보이고 있어 향후 치료 조합의 잠재적인 응용 가능성이 많은 약제이다.
하지만 문제점으로는 반응율이 20~30%로 낮고 확실한 치료 반응 예측 바이오마커가 없다는 것이다. 물론 PD-L1면역화학염색의 발현율을 통해 반응율을 예측하지만, 정확도에 한계를 가지고 있다. 또한 치료약제마다 서로 다른 PD-L1 면역화학 진단기법(동반진단)을 갖고 있으며, 그 치료 기준의 발현 정도가 달라 각각에 따라 의료보험 지급 기준이 다르다는 문제점이 있다.

